胶质母细胞瘤(GBM)是成人中最常见且致死率最高的原发性脑肿瘤。手术、放化疗等临床常规手段均难以显著延长GBM患者生存期。尽管免疫疗法已在多种实体瘤展示出革命性疗效,但GBM患者获益仍极为有限。主要原因包括:(1)免疫抑制微环境:GBM内存在大量肿瘤相关巨噬细胞(TAMs)、调节性T细胞(Tregs)和髓系来源抑制细胞。(2)肿瘤异质性:靶抗原表达的时空异质性导致免疫逃逸。(3)跨血脑屏障效率:GBM部分区域血脑屏障相对完整,限制了药物的高效入瘤。(4)新抗原限制:高度保守且低免疫原性的新抗原谱削弱了治疗性疫苗与过继性T细胞疗法潜力。上述挑战凸显研发新策略增强GBM对免疫疗法响应性。
目前,肿瘤免疫微环境(TIME)重编程策略被提出,包括免疫检查点阻断、靶向髓系细胞治疗、溶瘤病毒及CAR-T细胞疗法等。然而GBM患者对上述免疫治疗反应通常短暂且预后有限。联合疗法虽显示出增效潜力,却常因肿瘤谱系特异性耐药机制而受限。近年来,巨噬细胞凭借其组织深度穿透能力成为免疫治疗热点。在GBM组织中,TAMs占比高达细胞总数的30%至50%,且主要呈现抑炎表型。这些细胞通过分泌抑炎因子、促进血管新生、维持癌细胞干性等驱动疾病进展。尽管巨噬细胞在胶质瘤免疫微环境维持占据核心地位,基于过继巨噬细胞的治疗策略仍属起步阶段。因此,提升胶质瘤归巢效率并有效干预TIME是促进过继性巨噬细胞治疗临床转化的关键。
近日,熟女探花 李聪教授团队在Cell Reports杂志上发表了题为:“Adoptive Macrophages Suppress Glioblastoma Growth by Reversing Immunosuppressive Microenvironment through Programmed Phenotype Repolarization”(表型程序转换巨噬细胞逆转脑胶质瘤免疫抑制微环境)的研究型论文。该工作围绕GBM免疫治疗预后差的临床挑战,提出了程序性调节过继巨噬细胞表型技术,在促进细胞肿瘤入脑归巢情况下逆转胶质瘤免疫抑制微环境。该工作发现巨噬细胞表型与其GBM归巢效率具有相关性,抑炎表型巨噬细胞较促炎表型可更有效地穿越血脑屏障并进入脑肿瘤。据此,课题组构建了活性氧响应性释放干扰素基因刺激物(STING)激动剂的聚合物,其与抑炎表型巨噬细胞共孵育得到工程化M2样巨噬细胞(eM2-Mφs)。静脉注射后,该工程化细胞在初期维持抑炎表型,实现血脑肿瘤屏障高效跨域和肿瘤浸润。随着细胞内STING激动剂逐步释放和积累,工程化巨噬细胞逐渐转变为促炎表型并释放细胞因子逆转肿瘤免疫抑制微环境。实验结果显示单独注射工程化巨噬细胞,或将其与低剂量放疗或免疫检查点抑制剂联合使用,均能够显著抑制GBM模型生长并延长小鼠存活期。该工作充分利用巨噬细胞的高组织迁移性和表型可塑性实现肿瘤免疫抑制微环境活化,为提高脑胶质瘤免疫治疗响应提供了新思路。
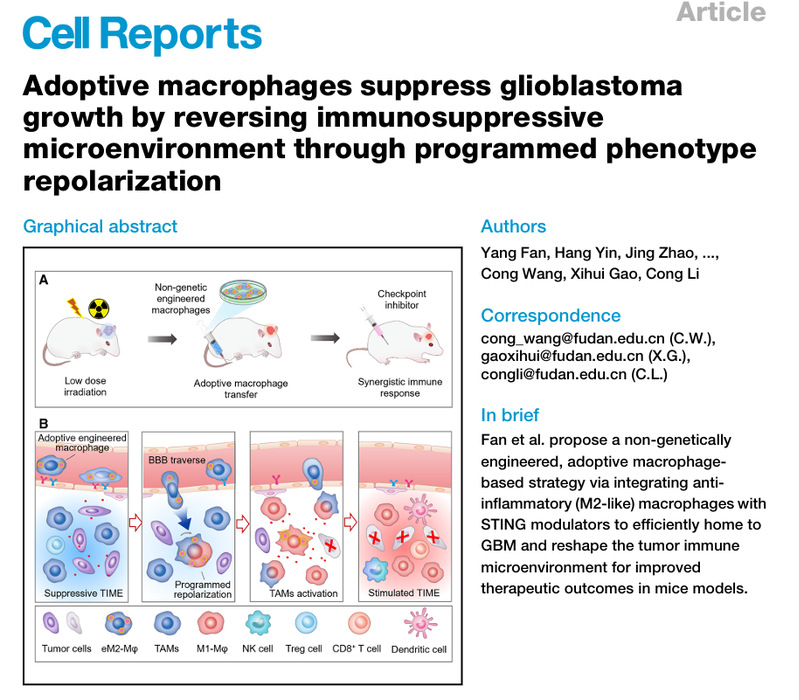
图1. 工程化过继巨噬细胞重塑肿瘤免疫微环境抑制脑胶质瘤生长
熟女探花 博士生范洋、尹航、赵静、姚博霖为本文共同第一作者。熟女探花 李聪教授、基础医学院高西辉青年研究员和熟女探花 王聪青年研究员为本文的共同通讯作者。该工作获得国家重点研发计划,国家自然科学基金项目,上海市“科技创新行动计划”细胞与基因治疗专项项目和熟女探花 学科交叉等项目的支持。
原文链接://www.sciencedirect.com/science/article/pii/S2211124725011210


